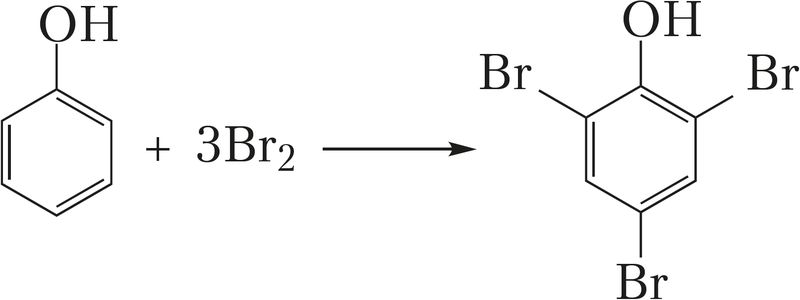
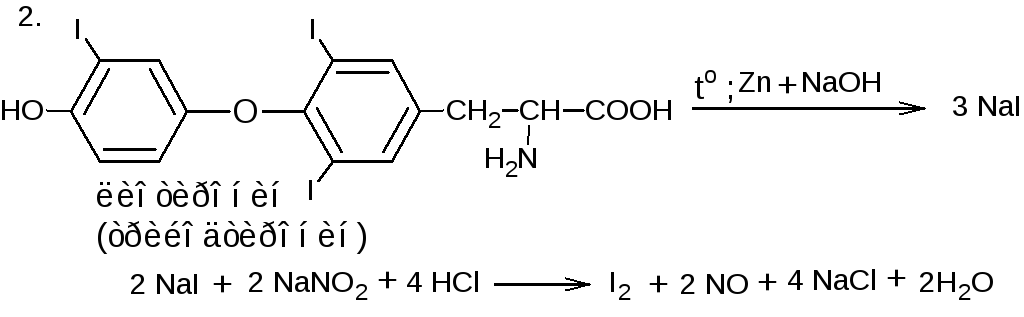
Ковалентно связанный галоген - Галогены: физические свойства, химические свойства

Галогены: физические свойства, химические свойства. Применение галогенов и их соединений
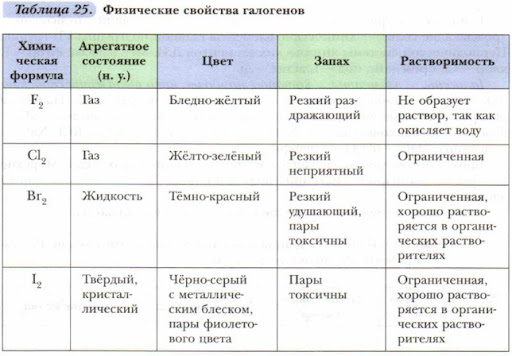
Удобная навигация, видео-разборы тем, задачи для самопроверки — всё это в вашем кармане. А ещё раздел с полезными материалами, календарь занятий и уведомления о предстоящих уроках. Физические свойства галогенов. Все галогены образуют двухатомные молекулы , наиболее прочной из которых является молекула хлора. Все галогены имеют очень резкий неприятный запах, вдыхание галогенов даже в небольших количествах вызывает раздражение дыхательных путей и раздражение слизистых оболочек. Галогены токсичны, особенно опасен фтор.

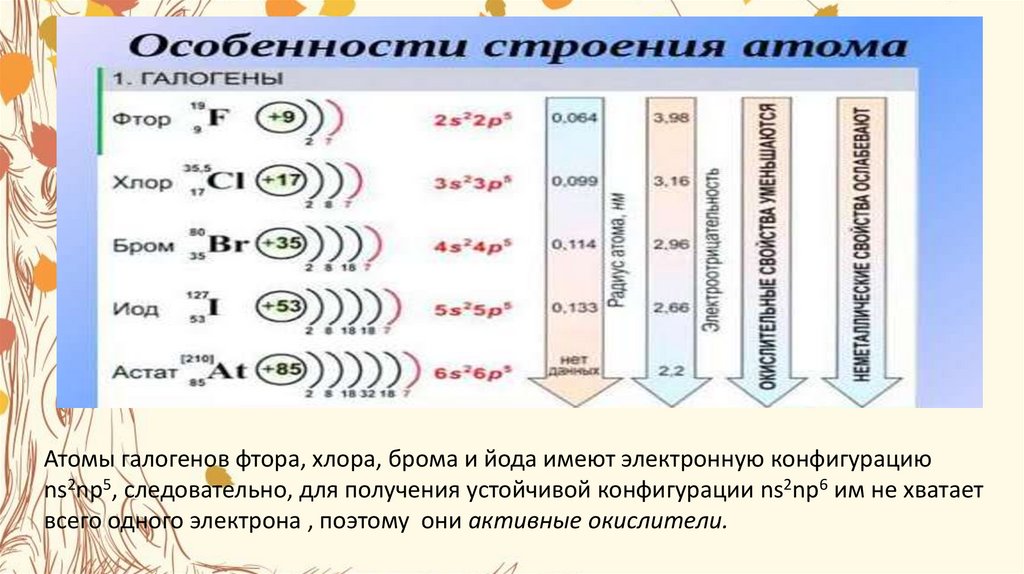




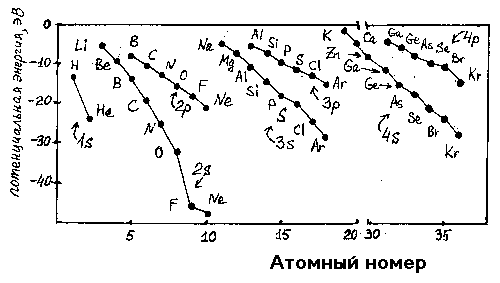
Для неметаллов характерно свойство присоединять электроны, проявлять окислительные свойства. Самый сильный окислитель — фтор. Окислительные свойства неметаллов возрастают в последовательности:. Фтор никогда не проявляет восстановительных свойств. Другие неметаллы и вещества, им соответствующие, могут проявлять восстановительные свойства, но они слабее, чем у металлов.
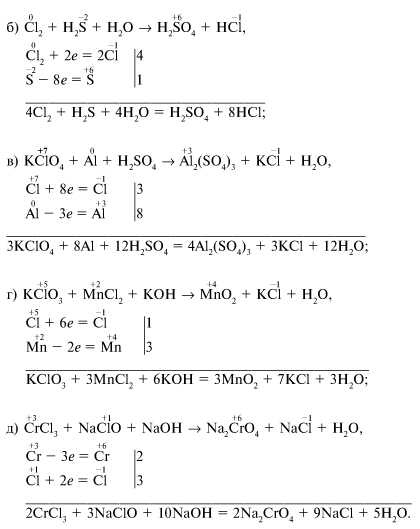
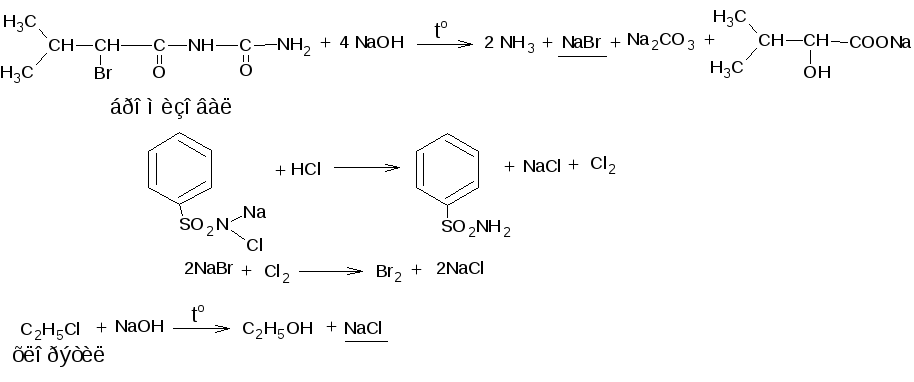








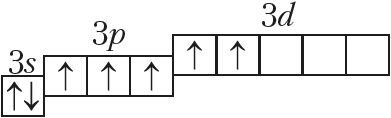

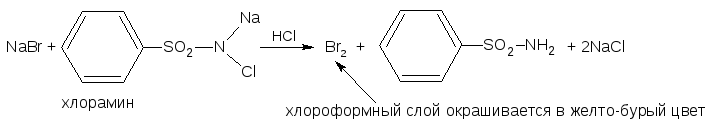
Менделеева по устаревшей классификации — элементы главной подгруппы VII группы [1]. Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители , поэтому встречаются в природе только в виде соединений. К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также формально искусственный элемент теннессин Ts. Все галогены — неметаллы , являются сильными окислителями.